Actualités
Pourquoi la capacité des batteries lithium-ion diminue-t-elle ?
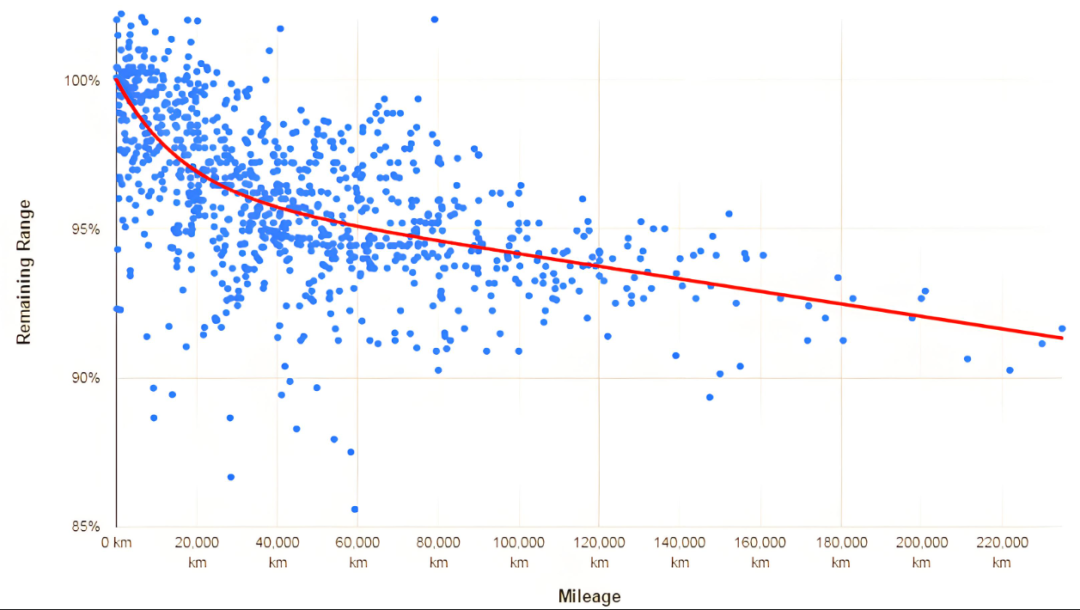
Piles au lithium-ion la perte de capacité fait référence au phénomène selon lequel les batteries lithium-ion perdent progressivement leur capacité disponible avec le temps et l'usure de la batterie. Quel est le mécanisme de la perte de capacité ?
1. Changement de volume
Durant le processus de charge et de décharge de la batterie, les ions lithium s'insèrent et se désinsèrent, provoquant une expansion/contraction plus ou moins importante des réseaux des matériaux d'électrode positive et négative.
A. La microstructure du matériau cathodique se modifie, ce qui entraîne une réduction de la quantité de lithium inséré. En cas de surcharge, les ions lithium migrent rapidement vers l'anode, provoquant l'effondrement du réseau cathodique.
B. La variation de volume du graphite de l'électrode négative lors de l'insertion et de l'extraction du les ions lithium lithium peut atteindre 10 %, entraînant un phénomène de stratification des particules.
2. Formation de la couche SEI
Durant la phase de formation de la batterie, les ions de lithium réagissent chimiquement avec certains composants de l'électrolyte lors du processus initial de charge et de décharge, formant une interface solide électrolytique irréversible à l'interface entre l'électrode négative et l'électrolyte. Durant le processus de charge et de décharge, l'interface SEI se rompt et se régénère continuellement, entraînant une diminution des ions de lithium actifs, une augmentation de l'épaisseur du film SEI et une augmentation de la résistance interne.
3. Croissance des dendrites de lithium
Sous des conditions de température basse, de charge rapide et de surcharge, les ions de lithium continuent de se déplacer vers l'électrode négative. La vitesse d'extraction des ions de lithium est supérieure à la vitesse d'insertion des ions de lithium, ce qui entraîne le dépôt des ions de lithium près de l'électrode négative et une réduction du lithium actif.
4. Décomposition de l'électrolyte
La décomposition de l'électrolyte se produit principalement par deux voies : la décomposition électrochimique et la décomposition chimique. La décomposition électrochimique se divise en décomposition oxydative du côté de l'électrode positive et décomposition réductive du côté de l'électrode négative. La décomposition oxydative du côté de l'électrode positive se produit lorsque le potentiel de l'électrode positive est supérieur à 4,5 V, provoquant un gonflement de la batterie et une augmentation de l'impédance interfaciale. La décomposition réductive du côté de l'électrode négative se produit lorsque le potentiel de l'électrode négative en graphite est inférieur à 0,8 V, entraînant l'épaississement de la couche SEI de la batterie et une réduction du lithium actif. La décomposition chimique se divise en réactions catalysées par l'eau résiduelle et réactions de décomposition à haute température. Les réactions catalysées par l'eau résiduelle provoquent la corrosion de l'électrode positive. Les réactions de décomposition à haute température provoquent l'évaporation de l'électrolyte, entraînant une tendance au déclenchement d'un emballement thermique.
5. Corrosion des collecteurs de courant
La corrosion du collecteur de courant se divise en corrosion de la feuille d'aluminium de l'électrode positive à haut potentiel et corrosion de la feuille de cuivre de l'électrode négative à bas potentiel. Lorsque le potentiel de l'électrode positive dépasse 3,8 V, la feuille d'aluminium de l'électrode positive s'oxyde et se corrode. En cas de surcharge, lorsque le potentiel de l'électrode négative est inférieur à 3 V, la feuille de cuivre se dissout, migre vers l'électrode positive et se dépose sur la surface de l'électrode positive.
Il y a également une défaillance des agents conducteurs et un vieillissement des séparateurs.


